Pour en finir avec les mythes entourant le traitement de l’hépatite C au Canada

Depuis 2014, des médicaments très efficaces, appelés antiviraux à action directe (AAD), ont été approuvés au Canada pour le traitement de l’infection par le virus de l’hépatite C chez les personnes de 18 ans et plus. Ces médicaments sont bien tolérés et efficaces à près de 100 %, et la durée du traitement n’est que de huit ou douze semaines. Les AAD ont grandement simplifié le traitement de l’hépatite C, de sorte que celui-ci peut désormais être prescrit par des prestataires de soins primaires, comme les infirmier·ère·s praticien·ne·s et les médecins de famille.
Maintenant que le traitement est simplifié, l’aspect le plus complexe et le plus épineux du traitement de l’hépatite C au Canada est l’obtention d’une couverture pour le remboursement des AAD. Près de 90 % des demandes de remboursement des AAD sont couvertes par les régimes d’assurance médicaments au pays; or, comme la couverture des médicaments d’ordonnance financée par l’État est très complexe, le remboursement des AAD fait l’objet de bien des malentendus, tant du côté des patient·e·s que du côté des prestataires. En fait, la situation concernant les AAD est si complexe que l’un des principaux rôles des programmes de soutien des patient·e·s créés par les fabricants est d’aider les patient·e·s à comprendre la procédure et à demander le remboursement. Il en résulte des idées fausses sur les AAD, dont beaucoup contribuent à entraver l’accès aux soins des personnes atteintes d’hépatite C, en particulier les Autochtones et les personnes qui utilisent des drogues.
Dans le cadre de mes travaux de recherche et de mes interactions avec des décideur·euse·s et des prestataires de soins de santé, j’ai été confrontée à un grand nombre de ces idées fausses et de ces mythes, dont je résume les quatre plus courants ci-dessous, suivi des faits et des données probantes permettant de les réfuter. S’assurer que tout le monde comprend bien comment les AAD sont couverts par les régimes publics d’assurance médicaments au Canada contribue à éliminer les obstacles aux soins et à réduire les inégalités en matière de santé pour les personnes touchées par l’hépatite C.
Mythe no 1 : Lorsqu’un médicament contre l’hépatite C est approuvé par Santé Canada, tout le monde au pays peut y avoir accès.
L’approbation d’un nouveau médicament par Santé Canada fait souvent l’objet d’une couverture médiatique et d’une attention particulière. Bien entendu, cette approbation signifie uniquement que le produit pharmaceutique peut être commercialisé et vendu au Canada. Il s’écoule en moyenne un an entre le moment où un nouveau médicament est approuvé par Santé Canada et celui où il est inclus dans les listes de médicaments couverts par les régimes publics. Ce délai s’explique par les examens supplémentaires requis avant que les régimes publics d’assurance médicaments ne décident de le couvrir ou non.
Avant qu’un régime public d’assurance médicaments puisse envisager d’ajouter à sa liste un agent nouvellement approuvé par Santé Canada, l’efficacité clinique et le rapport coût-efficacité de cet agent doivent faire l’objet d’une évaluation. Cette évaluation, appelée examen en vue du remboursement,est effectuée par l’Agence canadienne des médicaments et des technologies de la santé (ACMTS) ou, au Québec, par l’Institut national d’excellence en santé et en services sociaux (INESSS). Une fois l’examen terminé, un processus de négociation est amorcé par l’intermédiaire de l’Alliance pharmaceutique pancanadienne (APP) pour tenter de réduire le coût si le produit n’est pas jugé rentable. Si un accord est conclu confirmant la rentabilité du produit, les fabricants doivent alors soumettre une demande distincte à chacun des 13 régimes d’assurance médicaments provinciaux et territoriaux et des six régimes d’assurance médicaments fédéraux financés par des fonds publics, afin que leur produit soit ajouté aux listes de médicaments remboursables.
Par ailleurs, il existe des variations dans les critères appliqués par chaque régime public d’assurance médicaments pour l’ajout de produits à leur liste, notamment des critères cliniques et administratifs. Le temps qui s’écoule entre le moment où un médicament est initialement approuvé par Santé Canada et celui où il est inscrit pour la première fois sur la liste des médicaments remboursés peut également varier considérablement d’une province ou d’un territoire à l’autre. Par exemple, dans le cas du sofosbuvir/velpatasvir (Epclusa), le délai le plus court a été de 7 mois (en Ontario) et le plus long, de 9 mois (en Nouvelle-Écosse), comme le montre la figure 1. Dans le cas du glécaprévir/pibrentasvir (Maviret), le délai le plus court était de 17 mois (en Colombie-Britannique) et le plus long, de 28 mois (à Terre-Neuve-et-Labrador).
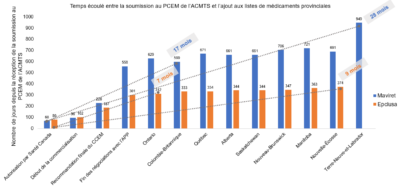
| Nombre de jours depuis la réception de la soumission | ||
|---|---|---|
| Étapes vers l’inscription du produit aux listes de médicaments Canada | Maviret | Epclusa |
| Soumission au PCEM de l’ACTMS (avant l’AC) | 0 | 0 |
| Autorisation par Santé Canada | 68 | 80 |
| Début de la commercialisation | 96 | 102 |
| Recommandation finale du CCEM | 228 | 187 |
| Fin des négociations avec l’APP | 558 | 301 |
| Ontario | 629 | 312 |
| Colombie-Britannique | 599 | 333 |
| Québec | 671 | 334 |
| Alberta | 661 | 344 |
| Saskatchewan | 661 | 344 |
| Nouveau-Brunswick | 706 | 347 |
| Manitoba | 721 | 363 |
| Nouvelle-Écosse | 691 | 374 |
| Terre-Neuve-et-Labrador | 949 | |
Mythe no 2 : Le traitement de l’hépatite C par les AAD coûte 50 000 dollars par cycle de traitement.
L’APP mène les négociations concernant le prix courant des médicaments de marque au Canada, conjointement avec les 13 gouvernements provinciaux et territoriaux, le gouvernement fédéral et les fabricants de médicaments. Cependant, les gouvernements des diverses provinces et territoires entreprennent également leurs propres négociations avec les fabricants lorsqu’ils acceptent d’inscrire un produit sur leur liste, ce qui permet souvent de réduire davantage les coûts finaux. Les ententes conclues dans le cadre de ces négociations, connues sous le nom d’ententes relatives à l’inscription des médicaments, sont strictement confidentielles et les gouvernements sont liés par des accords de non-divulgation.
Souvent, les ententes relatives à l’inscription des médicaments stipulent que le régime public d’assurance médicaments paiera le prix courant d’un médicament, mais sera ensuite remboursé par le fabricant pour un montant convenu, en fonction du respect de certains critères. Ces contrats de rabais réduisent effectivement le coût final d’un médicament pour les régimes publics d’assurance médicaments, mais la transparence fait défaut concernant le coût final, qui est presque certainement bien inférieur au prix courant.
L’opacité et le secret entourant les ententes relatives à l’inscription des produits, en particulier pour les produits pharmaceutiques annoncés comme étant des « médicaments à coût élevé », créent la confusion dans l’esprit du grand public et des prescripteur·trice·s eux·elles-mêmes. Ces dernier·ère·s ne connaissent que le prix courant d’un médicament, et non le coût réel pour le régime public, une fois que le fabricant a versé les remises convenues. Par exemple, le prix moyen payé par les régimes publics d’assurance médicaments canadiens par patient·e (c’est-à-dire le prix courant) pour les comprimés de glécaprévir/pibrentasvir (Maviret) s’élevait à 41 088 $ en 2019. Cependant, il ne s’agit pas là nécessairement du coût final que les régimes publics pourraient avoir à payer par patient·e traité·e par le glécaprévir/pibrentasvir (Maviret), et souvent les économies deviennent plus importantes à mesure que le nombre de patient·e·s traité·e·s augmente.
Mythe no 3 : Le traitement par AAD est accessible au Canada pour tou·te·s les enfants âgé·e·s de 3 à 12 ans.
Le 7 avril 2022, Santé Canada a autorisé une nouvelle préparation en granules de glécaprévir/pibrentasvir (Maviret) pour le traitement de l’hépatite C chez les enfants âgés de trois à 12 ans. Bien que l’ACMTS ait récemment publié un examen rapide des AAD contre l’infection chronique par le virus de l’hépatite C chez l’enfant ou l’adolescent, ni l’ACMTS ni l’INESSS n’avaient encore annoncé l’examen du remboursement des granules de glécaprévir/pibrentasvir (Maviret) en date du 24 février 2024. Une demande d’examen en vue d’un remboursement doit être faite directement par le fabricant si ce dernier souhaite que les régimes d’assurance médicaments publics couvrent son produit, et il doit payer des frais à l’ACMTS et à l’INESSS. Les régimes publics peuvent choisir d’examiner indépendamment un médicament qui n’a pas encore fait l’objet d’un examen en vue d’un remboursement par l’ACMTS ou l’INESSS. Cela dit, le fabricant d’un médicament qui n’a pas fait l’objet d’une évaluation par l’ACMTS ou l’INESSS n’est pas en mesure de demander aux régimes publics canadiens d’inscrire son produit sur la liste des médicaments remboursés.
Depuis que la nouvelle préparation a été approuvée par Santé Canada, les patient·e·s d’âge mineur atteint·e·s d’une infection chronique par le virus de l’hépatite C n’ont pu recevoir un traitement par AAD qu’en vertu d’une couverture exceptionnelle ou d’essais cliniques, ou en payant le prix total du médicament. Les patient·e·s qui n’ont pas les moyens de payer ce prix total peuvent bénéficier d’une aide dans le cadre du programme de soutien d’AbbVie, également connu sous le nom d’usage à titre compassionnel. L’approbation de l’usage à titre compassionnel par les fabricants ou de la couverture à titre de médicament d’exception par un régime public prend souvent beaucoup de temps, et la procédure d’accès est lourde et laborieuse pour les prescripteur·trice·s. Par conséquent, il est probable que seule une petite proportion des enfants âgé·e·s de 3 à 12 ans atteint·e·s d’hépatite C au Canada ont pu accéder à un traitement par AAD depuis que l’association glécaprévir/pibrentasvir en granules (Maviret) a été approuvée par Santé Canada en avril 2022.
Lorsque les prestataires de soins de santé communiquent des renseignements sur le traitement de l’hépatite C chez les enfants âgé·e·s de trois à douze ans au Canada, il est essentiel qu’ils et elles expliquent également qu’à l’heure actuelle, le médicament n’est pas inscrit sur les listes de médicaments des régimes publics et que les patient·e·s pourraient avoir besoin d’un soutien plus important pour obtenir un remboursement. Ne pas partager ces renseignements peut donner aux patient·e·s d’âge mineur atteint·e·s d’hépatite C, ou à leurs familles et soignant·e·s, la fausse impression que les médicaments sont disponibles et facilement accessibles.
Mythe no 4 : Les personnes vivant avec une infection chronique par le virus de l’hépatite C n’ont qu’une seule chance de bénéficier d’un traitement par AAD.
Les personnes vivant avec l’hépatite C rapportent souvent que les prestataires de soins refusent de leur prescrire un traitement par AAD tant qu’elles n’ont pas satisfait à certains critères ou attentes. Parmi les critères fréquemment cités figurent l’abstinence de substances illicites, la stabilisation de leur état grâce à un traitement par agoniste opioïde ou l’abstinence d’alcool. Les prestataires indiquent que ces critères sont nécessaires pour s’assurer que les patient·e·s observeront leur traitement ou seront en mesure de se protéger contre une réinfection par l’hépatite C après avoir été guéri·e·s. Si les objectifs d’observance du traitement et de prévention de la réinfection sont importants à prendre en compte au moment d’évaluer si le ou la patient·e est prêt·e à amorcer un traitement, il est également important que les personnes vivant avec l’hépatite C soient aux commandes quand il s’agit de leurs propres soins de santé. Autrement dit, leurs objectifs personnels et leurs préférences doivent être pris en compte, et les décisions relatives à l’instauration d’un traitement par AAD doivent être prises en collaboration avec ces personnes et leurs prestataires de soins.
Les prestataires peuvent ne pas être d’accord avec cette façon de faire et invoquer le fait qu’il leur incombe à eux ou elles de veiller à ce que les médicaments financés par l’État soient utilisés de manière appropriée. Cependant, chaque régime d’assurance médicaments détermine les critères d’admissibilité d’un·e patient·e au remboursement des coûts du traitement, et il incombe aux régimes d’assurance médicaments de déterminer si les demandes de couverture sont admissibles. Dans une étude menée en 2023 sous ma supervision, nous avons constaté que l’abstinence de drogues ou d’alcool ne figurait pas parmi les critères d’admissibilité au remboursement des AAD par les régimes publics d’assurance médicaments au Canada.
Nous avons par ailleurs constaté qu’un régime d’assurance médicaments (Terre-Neuve-et-Labrador) ne couvrait pas à l’époque le remboursement d’un traitement ultérieur par AAD en cas de réinfection, mais six régimes le couvrent de manière inconditionnelle; les autres régimes le couvrent au cas par cas. Il n’est donc pas exact de dire que les personnes vivant avec une infection chronique par le virus de l’hépatite C n’ont « qu’une seule chance » de bénéficier d’un traitement par AAD. La grande majorité des régimes publics d’assurance médicaments au Canada reconnaissent que pour atteindre les objectifs d’élimination de l’hépatite C, il est nécessaire de couvrir les AAD lors d’une reprise du traitement dans les cas de réinfection par le VHC. En outre, le traitement de l’hépatite C réduit grandement le risque de mortalité liée au foie et de mortalité toutes causes confondues. Si l’on est très conscient du coût substantiel des AAD, on l’est beaucoup moins des coûts élevés des soins de santé associés à l’hépatite C chronique lorsque celle-ci n’est pas traitée. Ainsi, en dépit du coût des AAD, le traitement de la primo-infection et de toute infection subséquente par le VHC est attrayant sur le plan économique pour le système de santé publique au Canada.
Régime national d’assurance médicaments : la solution pour simplifier la couverture des médicaments au Canada
Les études sur les systèmes d’assurance médicaments au Canada ont montré à maintes reprises que nos politiques actuelles de couverture des médicaments échouent à de multiples égards. Les données publiées indiquent qu’un régime public d’assurance médicaments universel et complet est la stratégie la plus appropriée pour résoudre ce problème. En 2019, le Conseil consultatif sur la mise en œuvre d’un régime national d’assurance médicaments a remis son rapport final, qui recommande un régime national d’assurance médicaments universel, complet, intégral, transférable, financé et administré par l’État.
En mars 2022, le gouvernement du Canada s’est engagé à adopter une Loi canadienne sur l’assurance médicaments en 2023 et à élaborer une liste de médicaments et un plan d’achat en gros pour les médicaments essentiels d’ici 2025. Les libéraux et les néo-démocrates seraient parvenus à un accord sur une loi définissant le cadre de mise en œuvre d’un régime universel d’assurance médicaments, loi qui devrait être présentée en mars 2024. Toutefois, une grande incertitude règne quant à la capacité du gouvernement à faire adopter cette loi et quant aux médicaments que le régime national d’assurance médicaments couvrirait.
Toute discussion sur la question de savoir si un régime national d’assurance médicaments réduirait les obstacles à l’accès aux AAD pour le traitement de l’hépatite C est purement spéculative, car aucune étude n’a encore été publiée sur ce sujet. Un système à payeur unique réduirait probablement le délai entre l’approbation par Santé Canada et le moment où tou·te·s les Canadien·ne·s seraient en mesure de se faire rembourser le médicament par leur régime public. En outre, compte tenu des résultats d’études récentes examinant l’impact de la distribution gratuite de médicaments en Ontario, il semble qu’il y ait des arguments convaincants en faveur d’un régime national universel d’assurance médicaments, lequel faciliterait l’accès au traitement de l’hépatite C et l’adoption de ce traitement.
Remarque : Plusieurs des hyperliens de ce billet de blogue, rédigé en langue anglaise à l’origine, pointent vers des articles et références en anglais, notamment en ce qui concerne les études citées.
Sofia Bartlett, Ph. D., est directrice scientifique par intérim des services de prévention clinique du British Columbia Centre for Disease Control. Elle est également professeure adjointe à l’École de santé publique et de santé des populations de l’Université de la Colombie-Britannique. Épidémiologiste des maladies infectieuses et chercheuse, elle étudie selon des principes de recherche par méthodes mixtes les intersections entre les infections transmissibles sexuellement et par le sang, d’une part, et l’incarcération, l’usage de substances et l’exclusion numérique, d’autre part.
